En esta nueva entrada os voy a enseñar un experimento que llevamos desarrollando en clase de física y química desde la semana pasada. Como buen experimento que es fuimos al laboratorio para llevarlo a cabo. Y como también habréis podido adivinar por el título, la práctica se basaba en los enlaces químicos, pero es más complejo que eso. Teníamos que comprobar si ciertas sustancias, que todos tenemos por casa, conducían la electricidad a través de ellos o no. Y después, elaborar un informe científico sobre el experimento explicando los materiales, resultados…


Lo primero que hicimos, antes de ir al laboratorio, fue leernos el documento que nos mando nuestro profesor en el que se explicaba que íbamos a hacer, para qué, como… Y también había teoría sobre los enlaces químicos (metálicos, covalentes e iónicos), donde s explica que son, como se forman… Ya que no podemos hacer un experimentos sobre enlaces químicos, si ni siquiera sabemos lo que son Todo esto es muy importante, ya que no podemos llegar al laboratorio y no saber que hay que hacer, y pasearnos por ahí como pollos sin cabeza. Os dejo por aquí el documento, también aparecen tablas y ejercicios para luego hacer el informe: https://FichaPrácticaLaboratorio.
Pero yo os voy a resumir lo que teníamos que hacer, en lo que se basaba la práctica. Básicamente teníamos que coger ocho sustancias (dos eran opcionales) y conectarlas a un circuito formado por una pila y una bombilla. Si al enchufar la sustancia en cuestión a la pila y la bombilla, esta lucía significa que conduce la electricidad, y si no lo hace, pues no conduce. Esto depende mucho de los enlaces que forman dicho producto. Ademas, lo probamos tanto en seco como en agua, para ver como reaccionaban, o si cambiaba algo.
Y una vez que tenemos claro lo que tenemos que hacer, la teoría, los materiales… y todo eso. Ya podemos ir al laboratorio, peeeero un detalle muy importante y que se nos suele olvidar son las normas del laboratorio, ya que es un sitio pequeño, con mucha gente, utensilios de cristal, sustancias (que podrían ser peligrosas)… podría terminar en drama todo esto. Por eso, creo que todos deberíamos tener claras las normas, para saber que es lo que podemos y no podemos hacer mientras estamos allí. Os dejo aquí las normas que nos pasó nuestro profesor: https://NormasLaboratorio.
Después de todo esto ¡ya podemos ir al laboratorio y empezar el experimento! Y eso hicimos, nos pusimos nuestras batas y entramos dispuestos a averiguar que sustancias conducían la electricidad y cuáles no.
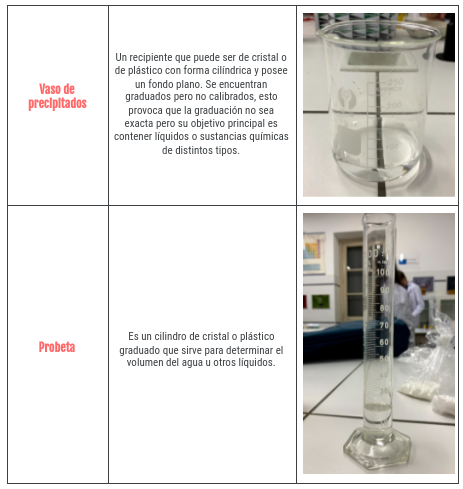
Ahora os voy enseñar los materiales de laboratorio que necesitamos para llevar a cabo el experimento, para ello hemos creado una tabla con una foto de cada herramienta y una pequeña descripción. La verdad es que no son materiales que suelen tener por casa, pero bueno, para eso vamos al laboratorio os dejo por aquí las fotos:
MATERIALES
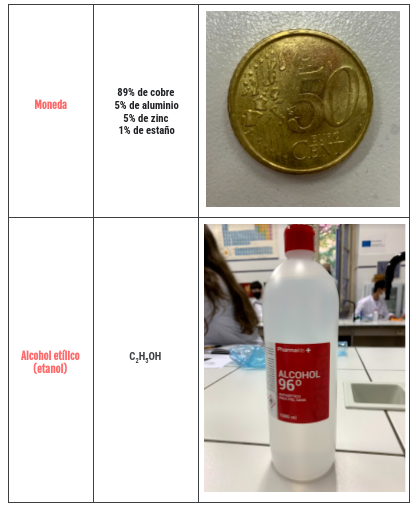
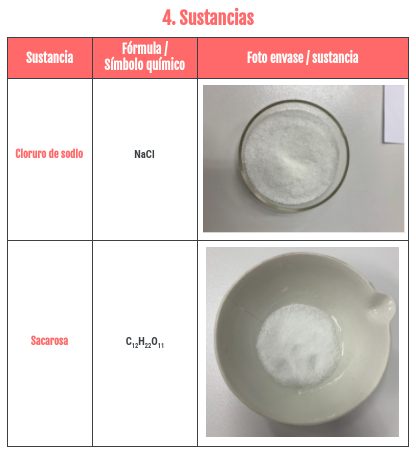
SUSTANCIAS / INGREDIENTES
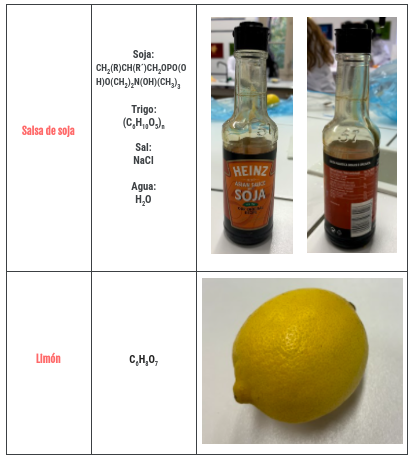
Y los mismo hemos hecho con las sustancias con las que teníamos que experimentar, solo que también hemos añadido sus fórmulas o símbolo químico, y las descripciones están todas del tirón en una lista.. Que por cierto, como os he dicho antes, dos de ellas las teníamos que elegir nosotras. Y tras un rato se nos ocurrió que podíamos hacerlo con vinagre y salsa de soja. También pensamos en utilizar Coca Cola, pero nuestro profesor nos dijo que era una sustancia muy compleja, y que mejor poco a poco 😉. Además, la mayoría de estos «ingredientes» se pueden encontrar fácilmente por casa, excepto el agua destilada. Por cierto, la segunda foto se ve muy borrosa, pero si pincháis en ella se ve bien.


ELABORACIÓN
Y ahora os voy a explicar como fuimos haciendo el experimento, los pasos que seguimos…
Lo primero que hicimos fue montar el circuito en el que más tarde conectamos las sustancias, lo cierto es que no teníamos ni idea de electricidad ni circuitos, pero era bastante sencillo y solo necesitábamos una pila de petaca, una portalámparas con una bombilla y tres cables, bueno y la sustancia que queríamos conectar. Os dejo aquí un dibujo que hice del esquema del circuito.
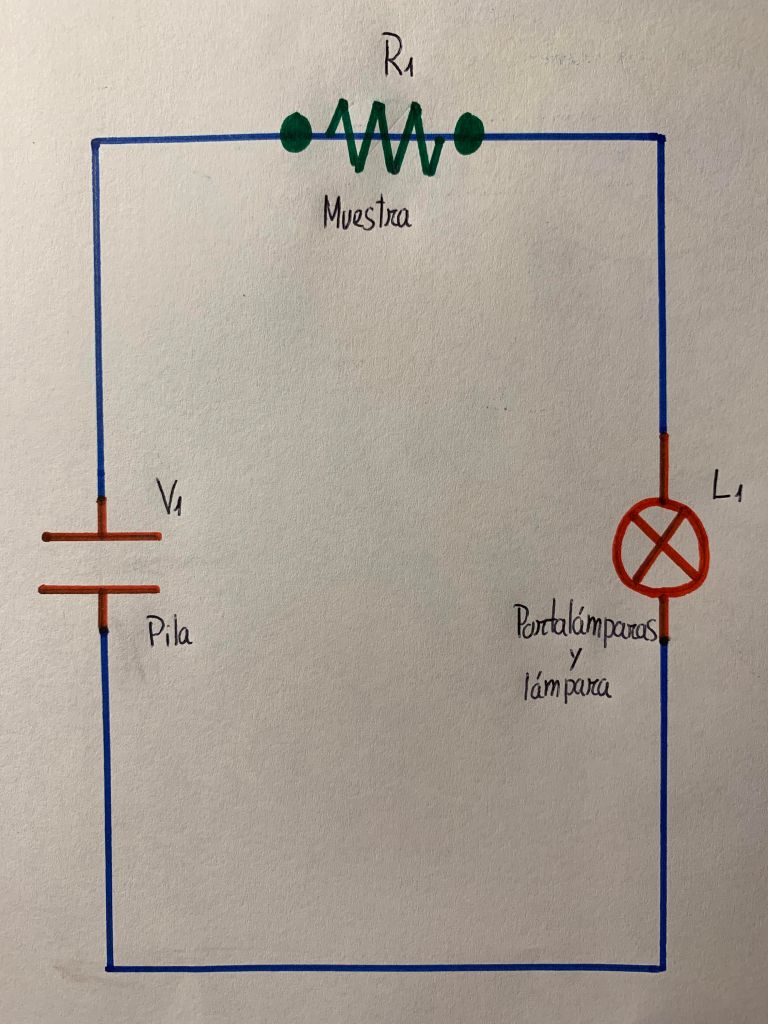
Primero probamos el circuito sin ninguna sustancia, para comprobar que todo funcionaba, y luego ya sí empezamos a añadirle productos. Algo curioso es que los cables se desconectaban todo el rato de la pila, y tuvimos que pegarlos con una cintar adhesiva especial que conduce la electricidad.

Y ahora voy a explicaros como hicimos las sustancias en seco (me refiero a sin diluirlas en agua), cogiendo una como ejemplo, porque en el fondo es hacer lo mismo varias veces. He decidido usar como ejemplo el cloruro de sodio, osea la sal.


Pues como ya os he explicado antes cogimos los 30g de sal y los echamos en una cápsula de porcelana e introducimos los extremos metálicos de los cables del circuito en ella, intentado que no tocaran el recipiente, y solo la sal. Cuando hicimos esto, pudimos ver la bombilla no se encendía, ni un poquito, lo que significaba que la sal no conduce. A continuación cogimos el multímetro y medimos su Voltaje, Resistencia e Intensidad, para comprobar si se cumplía la ley de Ohm y apuntamos tres mediadas de cada magnitud para luego poder obtener una media realista. Como podéis ver en las fotos, la sal no nos condució la electricidad, porque la bombilla no se encendió.



Después hicimos eso con los otros 7 compuestos, pero como no voy a explicaros lo mismo 7 veces, os voy a dejar por aquí una presentación con muchas de «las mejores imágenes» y vídeos, es que no me decido solo por unos 😉.
Y para las sustancias disueltas en agua, que solo hicimos tres (por problemas de tiempo): Agua con sal, agua con moneda y agua con limón, lo mismo solo que lo mezclamos con agua, de manera que obtuvimos una disolución. Por cierto, para las disoluciones de la moneda y el limón utilizamos 40 ml de agua, y en la de sal 60 ml. Aquí tenéis otra presentación con la selección de las mejores fotos y unos cuantos vídeos (sobre todo de como hicimos la disolución de la sal).
Una vez teníamos todas las sustancias hechas (o al menos las que nos dio tiempo), con sus medidas anotadas, fotos… Empezamos a elaborar el informe, basándonos en unas instrucciones que nos dio el profesor y en los ejercicios que parecían en el documento que no servía de guía y os enseñé muy al principio de la entrada.
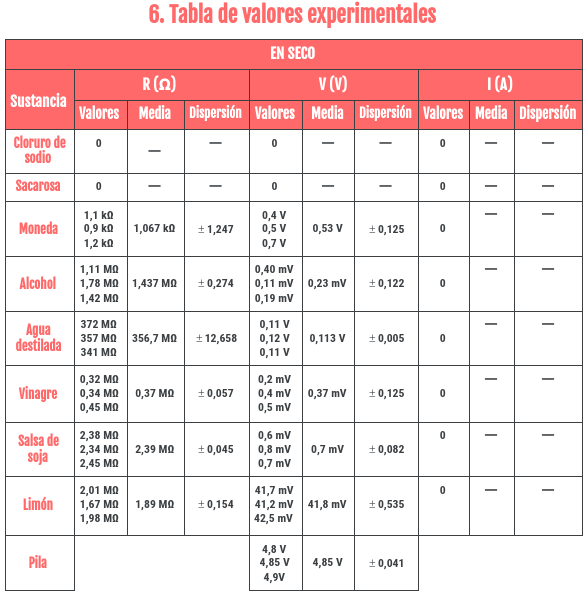
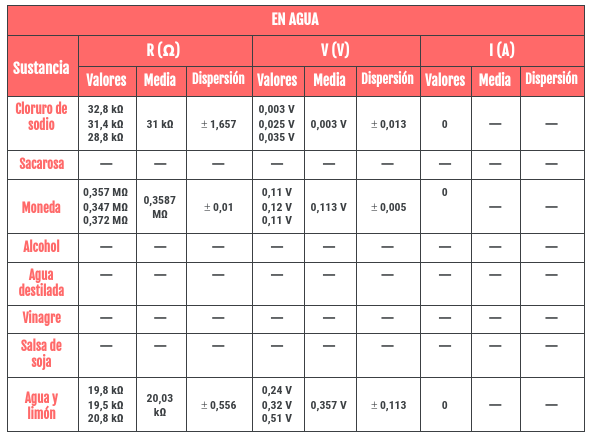
Os voy a dejar el enlace para que vosotros mismo podáis ver el informe, pero igualmente me gustaría destacar las tablas de cálculos que hicimos con las medidas que obtuvimos con el multímetro. En ellas añadimos los datos que obtuvimos (por eso no os los he enseñado antes), la media de los tres y error de dispersión. Os dejo aquí la tabla para las sustancias en seco y en agua:
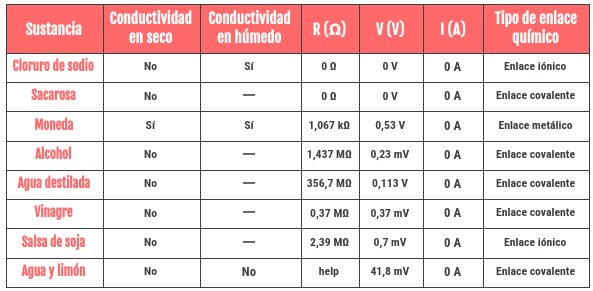
También quiero enseñaros otra tabla final que hicimos resumiendo los resultados del experimentos, en ella indicamos si la sustancia conduce la electricidad, en seco y en agua, sus valores de Voltaje, Resistencia e Intensidad en seco, y el tipo de enlace químico.
Lo siguiente que os quiero explicar es que decidimos crear un apartado extra en el informe científico con nuestras hipótesis sobre los posibles resultados de nuestro experimento. Esto os lo enseño ahora, pero lo hicimos antes de empezar el experimento, si no no tendría mucho sentido. Pusimos un poco de información sobre los enlaces químicos, y en función de eso intuimos si esas sustancia conduciría o no la electricidad. Mejor lo veis:

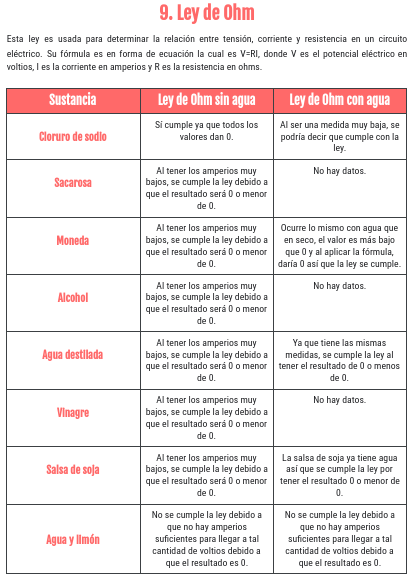
Por último también quería enseñaros un cuadro que hemos hecho explicando si se cumple o no la ley Ohm en las distintas sustancias, esto me parce muy interesante, ya que antes ni siquiera sabíamos lo que era.
Y por fin me dejo de rollos y os enseño como quedó nuestro informe científico, con sus tablas, explicaciones, fotos…. Hay alguna cosilla que nos he contado, es para que sea sorpresa, pero mejor que veáis vosotros el informe: https://InformeExperimento.
Con todo este experimento he aprendido un montón de cosas, por ejemplo: los tres tipos de enlaces químicos, sus principales características y si conducen o no la electricidad, y porque unas sustancias conducen y otras no. Qué es la electrolisis del agua, cómo utilizar un multímetro, cómo funciona un circuito eléctrico, las principales magnitudes relacionadas con la electricidad, que es la ley de Ohm. Además de cosas básicas para el laboratorio, que nos vendrán muy bien para el futuro, cómo que todas las sustancias que utilicemos hay que medirlas o que las mezclas se hacen en un vaso de precipitados y no en el primer recipiente que encontramos por ahí.
Todo esto lo he aprendido de diversas formas, pero principalmente, atendiendo y tomando apuntes sobre las explicaciones del profesor, leyendo los documentos que nos sirven de guía, investigando por internet y trabajando en equipo con mi compañera.

Sin duda lo que más me ha costado ha sido utilizar el multímetro para medir el voltaje, la resistencia y la intensidad de las sustancias. Ya que nunca antes habíamos utilizado uno y ni si quiera sabíamos cómo funcionaba, de hecho, no sabíamos nada sobre electricidad. Al principio nos resultó muy difícil entender como iba, porque por ejemplo metías las puntas de los cables en una sustancia los sacabas y los volvías a meter y marcaban un número completamente distinto. También nos costó entender qué magnitud teníamos que utilizar para cada sustancia ya que están los mini voltios y también están los voltios que se dividían en 2V 20V 200V. Resumiendo, lo que más me costo fue todo lo relacionado con la electricidad.


La verdad es que en parte sí salió como esperaba, pero a la vez no. Por un lado pudimos analizar todas las sustancias en seco y ver si conducían en la electricidad o no y apuntar sus valores. Pero por el otro, y desgraciadamente, solo nos dio tiempo a hacer tres sustancias de las disueltas en agua, las cinco restantes no pudimos hacerlas porque nos organizamos bastante mal y no nos dio tiempo. Me habría encantado poder realizar el experimento con todas las sustancias, ver qué habría pasado y poder decir que he completado el experimento “oficialmente”.

Por lo que si volviera a hacer este experimento cambiaría nuestra organización del tiempo. Quizá, para la próxima podemos preparar unas especies de horarios en las que anotemos qué debemos hacer en cada hora, perder menos tiempo, ser más eficientes y rápidas y estar más concentradas.

Y también aunque es menos importante, si volverá a realizar está práctica cambiaría la salsa de soja por otra sustancia mucho más sencilla, como la leche o el vinagre. Ya que la salsa de soja lleva otras muchas sustancias en su interior como sal o trigo, de hecho la sal es otra sustancia que hemos analizado, y esto hace que fuera más compleja y que hayamos tenido dudas a la hora de encontrar su fórmula o decidir qué tipo de enlace era.



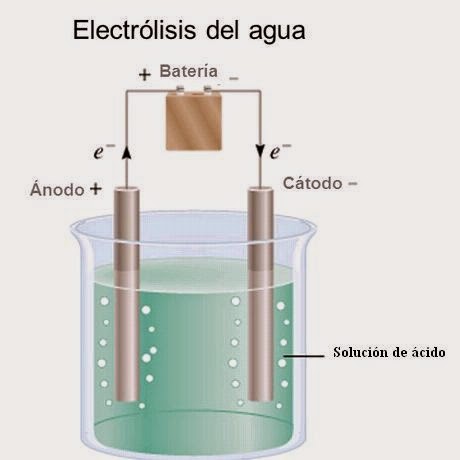
De todo el proceso destacaría el momento en el que hicimos la mezcla de cloruro de sodio y agua, os preguntaréis que tiene de especial. Pues resulta que introducimos los cables del circuito, que tenía una pieza metálica en su punta, hasta ahí todo bien. Pues resulta que al introducir esos cables en la mezcla, de repente, empezaron a salir burbujitas y una especie de mancha amarilla alrededor de la parte metálica. Y en cuánto lo sacábamos, este efecto paraba y al volver a meterlo volvía a empezar.
Le preguntamos a nuestro profesor que era y nos dijo que era la electrolisis del agua (es la descomposición del agua (H2O) en los gases oxígeno (O2) e hidrógeno (H2) mediante una corriente eléctrica continua, por una batería o una pila, que se conecta mediante electrodos al agua), si os fijáis es justo lo que nosotras hicimos. Esto nos pareció muy curioso ya que con todas esas burbujitas parecía gaseosa y la mancha amarilla era un poco sospechosa 😉, además, nos dimos cuenta de que al sacar el cable de las disolución, estaba más limpio, era como si le hubiera quitado una capa de óxido. Y lo sorprendente de todo esto, es que la mezcla solo era de agua y sal y produjo un efecto muy bonito y curioso.

Otro momento que me gustaría destacar es cuando hicimos las disolución de sal y agua, todo me pasa con la sal y el agua 😉. El tema es que echamos mucha sal (30g) para la cantidad de disolvente, osea de agua. Y por más que mezclábamos con la varilla en el vaso de precipitados esa sal no se disolvía. Así que optamos por calentar la mezcla con mechero Bunsen para facilitar este proceso (y ni por esas, seguía habiendo mucha sal, por lo que la disolución estaba sobresaturada). Esto me parece curioso, porque del mechero salía una llama importante, y ahí estábamos nosotras dando vueltas en el vaso de precipitados, como si fuera una hoguera 😂. Los vídeos son los mismo que os he enseñado antes durante el proceso, pero os los vuelvo a poner.






Todo esta de la electricidad y los enlaces químicos se puede aplicar a muchas cosas. Por ejemplo los desfibriladores que se utilizan cuando a alguien le da un paro cardiaco y emiten descargas eléctricas. O las pistolas tasers que tiene la policía. O por último las pilas eléctricas que son una fuente de energía que utilizamos muchísimo en nuestro día a día y son un claro ejemplo de enlace químico.



Este experimento me ha gustado mucho, porque hemos ido al laboratorio y hemos hecho algo diferente a lo que solemos hacer en clase. Además, me parece que es muy interesante aprender sobre los enlaces químicos y la electricidad, ya que es algo completamente nuevo para nosotros.
































Deja un comentario